- Этиленгликоль
-
Этиленгликоль 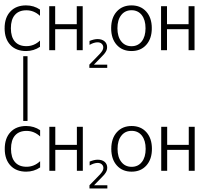
Общие Систематическое наименование этан диол-1,2 Традиционные названия этиленгликоль, 1,2-диоксиэтан, 1,2-этандиол Химическая формула C2H4(OH)2 Физические свойства Состояние (ст. усл.) жидкость Молярная масса 62,068 г/моль Термические свойства Температура плавления −12,9 °C Температура кипения 197,3 °C Классификация Рег. номер CAS 107-21-1 SMILES OCCO Безопасность Токсичность токсичен Этиленглико́ль (гликоль; 1,2-диоксиэтан; этандиол-1,2), HO—CH2—CH2—OH — простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу[1].
Содержание
История открытий и производства
Этиленгликоль впервые был получен в 1859 французским химиком Вюрцом из диацетата этиленгликоля омылением гидроксидом калия и в 1860 гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Южного Чарлстона (западная Вирджиния, США) компанией "Carbide and Carbon Chemicals Co." К 1929 году этиленгликоль использовался практически всеми производителями динамита. В 1937 кампания Carbide начало первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Получение
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190—200°С или при 1 атм и 50—100°С в присутствии 0,1—0,5 % серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются этиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60 % его потребления. Смесь 60 % этиленгликоля и 40 % воды замерзает при −45 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
-
- в качестве высокотемпературного растворителя.
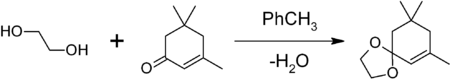
- для защиты карбонильной группы путём получения 1,3-диоксалана. Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора(толуолсульфоновой кислоты, насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана[2] или комплекса диметилсульфат-ДМФА[3] 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- Как компонент жидкости «И», используемой для предотвращения обводнения авиационных топлив.
- В качестве криопротектора
- Для поглощения воды, для предотвращения образования гидрата метана, который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенириуют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
Этиленгликоль также применяется:
- при производстве конденсаторов
- при производстве 1,4-диоксана
- компонент в составе систем жидкостного охлаждения компьютеров
- как теплоноситель в системах чиллер-фанкойл
- в качестве компонента крема для обуви (1—2 %)
- в составе для мытья стёкол вместе с изопропиловым спиртом
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
Концентрация % 30 35 40 45 50 55 60 Плотность, г/мл 1,050 1,058 1,067 1,074 1,082 1,090 1,098 Меры безопасности
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8- 6,4 % (по объему). Требования безопасности Этиленгликоль горюч, по степени воздействия на организм относится к веществам 3-го класса опасности. Этиленгликоль токсичен. Летальная доза при однократном пероральном употреблении составляет 100—300 мл этиленгликоля (1,5-5мл на 1 кг массы тела)[4]. Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол (англ. Fomepizole)[5].
См. также
Примечания
- ↑ Monograph on the Potential Human Reproductive and Developmental Effects of Ethylene Glycol
- ↑ SYNTHESIS 1983, No 3,pp 203—205
- ↑ Liebigs Annalen Chemie 1979, pp 1362—1369
- ↑ Medline.Ru — Отравления этиленгликолем и его эфирами
- ↑ Flomenbaum, Goldfrank et al. Goldfrank's Toxicologic Emergencies. 8th Edition. — McGraw Hill, 2006. — С. 1460, 1465. — 2170 с. — ISBN 0071437630
Ссылки
- Международная карта химической безопасности для этиленгликоля (рус.)
- Сертификаты на этиленгликоль (рус.)
- Краткие технические характеристики этиленгликоля (рус.)
- ГОСТ 19710-83. Этиленгликоль. Технические условия. (рус.)
- Об отравлениях этиленгликолем
 Категории:
Категории:- Нефтехимия
- Гликоли
- Продукция основного органического синтеза
- Климатическое и холодильное оборудование
Wikimedia Foundation. 2010.